Program służy do wyznaczenia okresu ważności zgodnie z rekomendacjami ICHQ1E na podstawie długoterminowych badań stabilności oraz badań przyspieszonych jak również do trendowania wyników gromadzonych podczas ciągłego badania stabilności.

Oprogramowanie umożliwia:
- ocenę długoterminowych, przyspieszonych i ciągłych badań stabilności produktu
- dobór odpowiedniej metody statystycznej do oceny badań stabilności produktu
- standaryzację przeprowadzanych analiz statystycznych i interpretację wyników
- generowanie pełnego raportu do złożenia dokumentacji rejestracyjnej
Program został tak przygotowany, aby po wprowadzeniu danych i naciśnięciu jednego przycisku otrzymać raport w postaci dokumentu Microsoft Word lub PDF. Oprócz wyników wykonanych analiz, w raporcie znajdują się komentarze ułatwiające interpretację otrzymanych rezultatów.
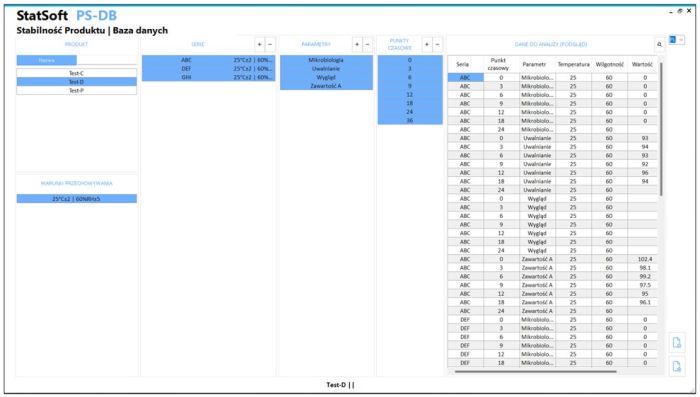
Opcjonalnie, dane mogą być składowane w dedykowanej bazie danych.
Oprogramowanie zostało zwalidowane zgodnie z wymaganiami cGMP.
Główne funkcjonalności:
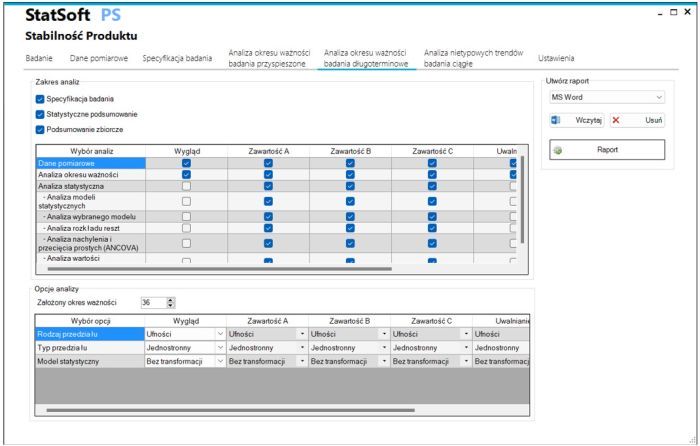
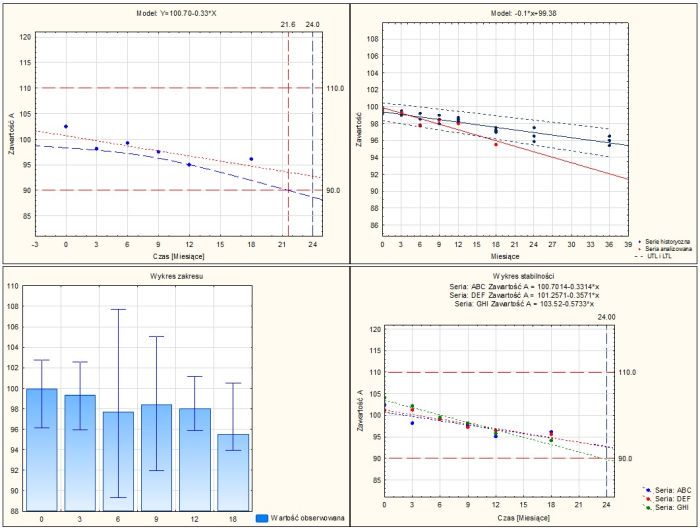
- Badania długoterminowe
- Wyznaczenie okresu ważności na podstawie przedziału ufności i/lub przedziału predykcji
- Wyznaczenie okresu ważności na podstawie jednostronnego lub dwustronnego przedziału
- Wybór liniowego modelu statystycznego bez transformacji lub po transformacji danych
- Ocena dobroci dopasowania wszystkich dostępnych modeli statystycznych
- Analiza statystyczna istotności wybranego modelu za pomocą testu t i testu F
- Analiza poprawności wybranego modelu za pomocą analizy reszt
- Analiza wielu serii z oceną możliwości uwspólnienia danych metodą ANCOVA
- Analiza wartości przewidywanych dla wybranego przedziału czasowego
- Zbiorcze podsumowanie analizy dla wszystkich badanych serii/parametrów
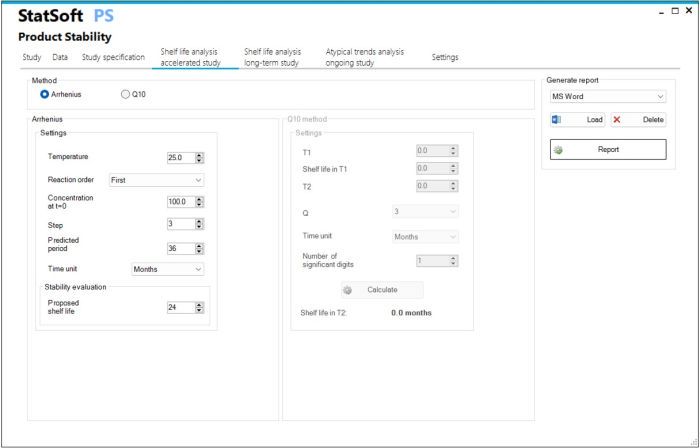
- Badania przyspieszone
- Szacowanie okresu ważności na podstawie modelu Arrheniusa
- Szacowanie okresu ważności na podstawie metody Q10
- Badania ciągłe
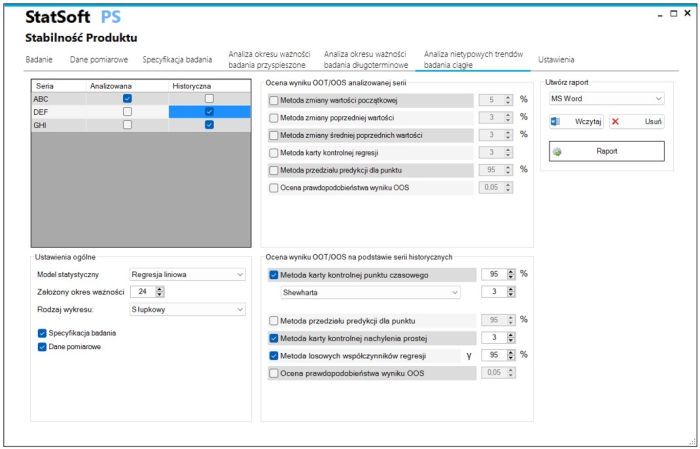
- Analiza wyniku poza trendem OOT w odniesieniu do serii historycznych
Metoda karty kontrolnej punktu czasowego
Metoda przedziału predykcji punktu czasowego
Metoda karty kontrolnej nachylenia prostej
Metoda losowych współczynników regresji
Ocena prawdopodobieństwa wyniku OOS - Analiza wyniku poza trendem OOT w odniesieniu do wcześniejszych punktów czasowych
Metoda zmiany od wartości początkowej, poprzedniej i średniej
Metoda karty kontrolnej regresji
Przedziału predykcji dla punktu
Ocena prawdopodobieństwa wyniku OOS
- Analiza wyniku poza trendem OOT w odniesieniu do serii historycznych
- Tworzenie raportów w formacie Word, e-CTD, PDF, Statistica, również w języku angielskim
- Konfigurowanie zawartości raportu z wyborem zakresu analiz statystycznych
- Tworzenie szablonów, zwierających skonfigurowany zakres analiz statystycznych
- Opcja: zapis wyników do bazy danych z pełną funkcjonalnością dziennika śledzenia
Dowiedz się więcej na temat oceny badań stabilności! Obejrzyj webinarium:
